Comprendre l’endométriose
Comprendre l’endométriose
Sur cette page vous retrouverez une présentation générale pour comprendre l’endométriose : la nature de la maladie, sa définition admise; les mécanismes hormonaux et inflammatoires à l’œuvre; son épidémiologie : sa prévalence, son incidence socioéconomique et les facteurs de risque; sa physiopathologie : son histoire et les théories sur l’origine du développement de la maladie.
Présentation générale
Nature et définition de l’endométriose
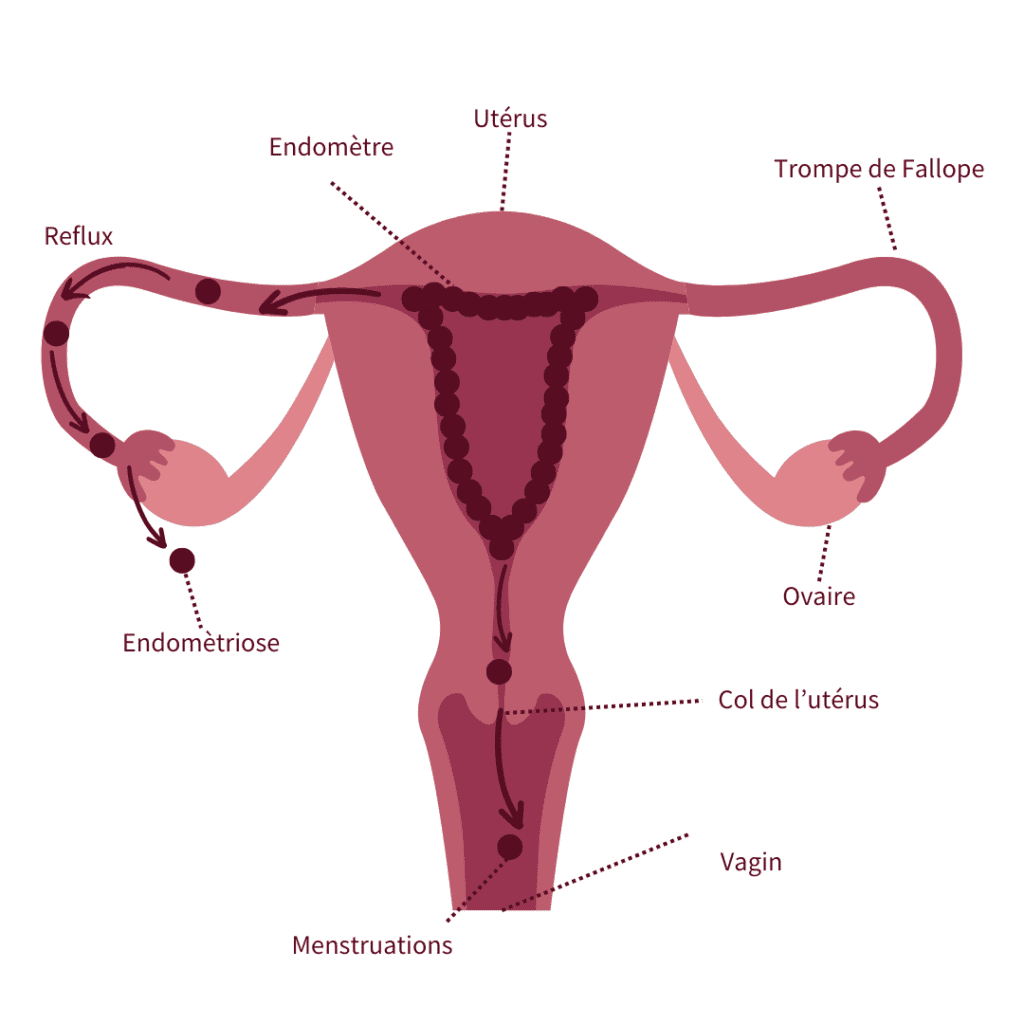
L’endométriose est une maladie gynécologique complexe, multifactorielle et oestrogéno-dépendante. Elle est caractérisée par la présence de tissu semblable à l’endomètre de la muqueuse utérine en dehors de l’utérus, principalement dans la cavité abdominale, provoquant de nombreux symptômes avec des conséquences fonctionnelles et psychologiques plurielles1, ainsi que des surrisques de développer d’autres maladies 2.
L’essentiel

Mécanismes de la maladie
Les mécanismes hormonaux
L’endométriose est une maladie hormono-dépendante. Les hormones impliquées, principalement les œstrogènes et la progestérone, régulent le cycle menstruel et influencent directement la croissance des tissus endométriaux sous la rétroaction des hormones gonadotropes FSH et LH.
Le cycle menstruel est un processus naturel d’une durée moyenne de 28 jours, se déroulant chaque mois chez les personnes porteuses d’un utérus en âge de procréer, afin de permettre au corps de se préparer à une éventuelle grossesse. Il est contrôlé par des hormones et se divise en plusieurs phases.
Le rôle des œstrogènes dans l’endométriose
Stimulation de la prolifération : Les œstrogènes favorisent naturellement la croissance et la prolifération des cellules endométriales en augmentant la néovascularisation et modifiant la réponse inflammatoire locale. Les implants endométriaux qui fonctionnent comme les cellules endométriales et possèdent des récepteurs pour les oestrogènes, sont donc particulièrement sensibles aux œstrogènes, ce qui stimule leur croissance . A contrario, en présence d’angrogènes comme la progestérone, les lésions s’atrophient (mais ne disparaissent pas). De plus, les personnes atteintes d’endométriose ont souvent une production excessive d’œstrogènes.
Production locale exacerbée : Les cellules endométriosiques peuvent produire des œstrogènes localement grâce à l’enzyme aromatase9, qui convertit les androgènes en œstrogènes. Cette production locale renforce la croissance des implants endométriosiques, créant un cycle auto-entretenu.
Le rôle de la progestérone
Résistance à la progestérone :Les tissus endométriosiques montrent une faible réponse à la progestérone, en partie en raison de la diminution des récepteurs à la progestérone, notamment le récepteur PR-B. Cette résistance réduit l’efficacité des traitements hormonaux à réguler et inhiber la prolifération des implants endométriaux, conduisant à un déséquilibre hormonal et expliquant pourquoi certains traitements ne parviennent pas à contrôler les symptômes et peuvent ne pas empêcher la progression de la maladie.10
Impact sur l’inflammation : La progestérone, ayant des effets anti-inflammatoires, est moins efficace en présence de résistance, contribuant ainsi à l’inflammation persistante associée à l’endométriose. Cette inflammation chronique stimule la production de cytokines et de facteurs de croissance, soutenant la survie et l’invasion des cellules endométriosiques.11
Les mécanismes inflammatoires
Les prostaglandines et leur rôle dans l’inflammation cyclique
Les prostaglandines sont des molécules lipidiques issues des phospholipides de la membrane cellulaire, produites en réponse à des signaux inflammatoires. Elles jouent un rôle clé dans la douleur, la fièvre, l’inflammation et la contractilité utérine et sont présentes naturellement chez les personnes non atteintes par l’endométriose.
Au moment des règles, l’endomètre se désagrège, entraînant une libération massive de prostaglandines, en particulier la PGE2 et la PGF2α. Cela provoque des contractions utérines pour expulser le sang et les tissus, mais aussi une hypersensibilisation nerveuse, source de douleur. L’ovulation s’accompagne également d’une libération ponctuelle de prostaglandines, qui participe à la rupture du follicule.
Chez les personnes atteintes d’endométriose, les prostaglandines sont souvent produites en excès, d’où des douleurs menstruelles (dysménorrhées) plus intenses et parfois non soulagées par les traitements classiques.
Les mécanismes inflammatoires de l’endométriose
La présence de tissu endométrial ectopique, notamment sur les ovaires, le péritoine, et d’autres organes abdominaux, déclenche une réaction inflammatoire anormale qui joue un rôle central dans la progression de la maladie et dans les symptômes ressentis. Sa présence provoque une réponse immunitaire locale.
Les cellules immunitaires, comme les macrophages, sont recrutées sur les sites des lésions, mais au lieu de résoudre le problème, elles libèrent des substances pro-inflammatoires telles que les cytokines et les prostaglandines. Ces substances amplifient l’inflammation et contribuent à la croissance des lésions endométriosiques. Parallèlement, d’autres cellules immunitaires, comme les mastocytes et les cellules Natural Killer (NK), qui devraient éliminer les cellules anormales, fonctionnent de manière défaillante, permettant aux lésions de persister.
Cette inflammation chronique déclenche un véritable cercle vicieux : les substances inflammatoires stimulent la production locale d’œstrogènes qui favorisent la prolifération des lésions. Ces lésions, à leur tour, continuent d’entretenir l’inflammation. En outre, cette réaction inflammatoire excessive conduit à la formation de fibrose et d’adhérences, c’est-à-dire de tissus cicatriciels anormaux qui lient les organes entre eux, perturbant leur fonctionnement normal.
De plus, l‘inflammation chronique irrite de manière excessive les petits nerfs qui innervent les organes du péritoines, mais aussi ceux présents dans les implants ectopiques qui sont excessivement innervés, rendant toutes ces zones très sensibles à la douleurs. Cette irritation entraine des dysfonctionnements des organes touchés et des douleurs au quotidien qui en se chronicisant induit une hypersensibilisation nerveuse qui affecte tout le système de gestion de la douleur. On a alors un cercle vicieux où l’inflammation et la douleur s’amplifient mutuellement, avec une prolifération des lésions, et de fibrose qui aggrave les symptômes.
Epidémiologie
L’endométriose en quelques chiffres
6 à 20%
des personnes en âge de procréer atteintes
9 579€/an
en moyenne de dépenses par patient.es en Europe
7 à 10 ans
de retard de diagnostic
Prévalence de l’endométriose
La prévalence de l’endométriose varie selon les sources et les populations étudiées, oscillant généralement entre 6 % et 10 % dans la population générale des personnes porteuses d’un utérus en âge de procréer21 et semble augmenter22 potentiellement en raison de changements dans les habitudes reproductives (moins de grossesses, allaitement réduit). Certains rapports suggèrent une prévalence pouvant atteindre 20 %, notamment parmi les personnes souffrant de douleurs pelviennes chroniques ou d’infertilité, où elle peut atteindre 35 % à 50 %23. Globalement, il est estimé que 190 millions de personnes en âge de procréer (entre 15 et 49 ans)24, sont touchées par l’endométriose dans le monde, dont environ 1,5 million en France25.
Toutefois on estime que cette pathologie est sous diagnostiquée.
Incidence socio-économique
L’endométriose a une incidence socioéconomique significative, notamment en raison de la douleur chronique et de la réduction de la qualité de vie qu’elle engendre. Aux États-Unis, le coût annuel total (soins directs et perte de productivité) de l’endométriose est estimé à environ 22 milliards de dollars26. En Europe, les coûts associés à l’endométriose sont estimés à 9 579 euros par personne atteinte chaque année, comparables à ceux du cancer du sein27. En France, l’endométriose coûterait environ 9,5 milliards d’euros par an28, incluant les coûts médicaux directs et la perte de productivité. Le retard diagnostic, estimé entre 7 et 10 ans29, contribue à l’aggravation des coûts en raison des complications et des soins intensifiés nécessaires qui auraient été épargnés avec un diagnostic plus précoce.
Facteurs de risque
L’endométriose est influencée par une combinaison complexe de facteurs hormonaux, génétiques, environnementaux, et liés au mode de vie. Bien que les mécanismes précis restent en grande partie à élucider, les recherches suggèrent que l’interaction de ces divers facteurs contribue au développement et à la progression de la maladie. Une meilleure compréhension de ces facteurs de risque pourrait conduire à des stratégies de prévention plus efficaces et à une gestion plus ciblée de la maladie.
Les facteurs de risque de l’endométriose sont basées sur des études épidémiologiques et des observations cliniques qui ont identifié des corrélations entre ces caractéristiques et une incidence plus élevée de l’endométriose. Toutefois les facteurs de risques peuvent varier d’une étude à une autre notamment par la variabilité des populations étudiées. Ces données sont à considérer avec recul et prudence d’autant plus que les mécanismes de causalités n’ont pas été expliqués ou compris.
Les facteurs hormonaux, menstruels et reproductifs
Un âge précoce des premières menstruations (avant 11 ans) 32 , une nulliparité33 (ne pas avoir d’enfants) induisent une exposition augmentée aux hormones et aux flux menstruel augmentant ainsi la prolifération et résistance des lésions, et un indice de masse corporelle bas (lié à une plus grande fréquence de cycles ovulatoires).34
Les facteurs génétiques
La contribution génétique dans le développement de l’endométriose est estimée à 51%35. Les personnes ayant des antécédents familiaux d’endométriose, (parent, fratrie…) ont un risque accru significatif (sûrement dû à des variations génétiques transmises)36. 42 régions du génomes abritent des variants corrélés à un risque d’endométriose.37
Les facteurs environnementaux
L’exposition à des perturbateurs endocriniens, à des polluants persistants et non persistants (des métaux comme le cadmium), des pesticides organochlorés, et des filtres UV de type benzophénone, des facteurs d’hygiène de vie comme la consommation d’alcool38 (10 g/jour), la carence en vitamine D 39, le travail de nuit, et l’alimentation 40 (consommation de viande rouge notamment)41 induisent un risque plus élevé d’endométriose.
Les facteurs psycho-sociaux
Des expériences traumatiques durant l’enfance, comme les abus sexuels44 ou les mauvais traitements45, peuvent augmenter le risque de développer la maladie en affectant le système hormonal et immunitaire. Le stress chronique46 (et sa gestion inadéquate), ainsi que des troubles tels que l’anxiété et la dépression, peuvent aussi favoriser l’apparition ou l’aggravation des lésions et amplifier la sensibilité à la douleur.
Physiopathologie
Histoire de la maladie
L’endométriose est une maladie ancienne, avec des descriptions possibles remontant à l‘Égypte antique et des mentions par les Grecs d’Hippocrate, qui associaient les symptômes à des troubles menstruels et à l’infertilité. À travers les âges, cette maladie a souvent été mal comprise et confondue avec des troubles psychologiques, notamment l’hystérie, entraînant des traitements inappropriés et une stigmatisation des personnes atteintes. Pendant le Moyen Âge, l’endométriose était perçue comme une manifestation de possession démoniaque, ce qui a mené à des interventions superstitieuses et parfois violentes.
La Renaissance a marqué un tournant avec des progrès en anatomie, permettant une meilleure identification des douleurs utérines, mais les croyances superstitieuses continuaient d’entraver la reconnaissance de la nature organique de la maladie. Du XVIIe au XIXe siècle, des médecins comme Daniel Schrön et Frederik Ruysch ont fait des avancées significatives en décrivant des symptômes caractéristiques de l’endométriose et en proposant la théorie du reflux menstruel. Au XIXe siècle, Karl von Rokitansky a observé pour la première fois des lésions microscopiques d’endométriose, mais la maladie restait décrite sous divers noms jusqu’à ce que John Sampson introduise le terme « endométriose » en 1927 et valide la théorie des menstruations rétrogrades.
Le XXe siècle a été marqué par des avancées majeures : Thomas Stephen Cullen a documenté les localisations et l’impact des lésions, et les progrès en endocrinologie ont conduit à l’utilisation de traitements hormonaux. Les innovations chirurgicales, telles que la coelioscopie, ont permis des traitements plus précis et moins invasifs. Malgré ces progrès, l’endométriose est restée largement sous-diagnostiquée jusqu’aux années 1970. Les personnes atteintes ont souvent été traitées comme des hystériques, parfois au point d’être internées en hôpital psychiatrique. Ce n’est que récemment que la maladie a commencé à être reconnue par la communauté médicale, en partie grâce à l’engagement des associations de patientes.
Ce n’est qu’en 2020, en France, qu’une page sur l’endométriose a été incluse dans le programme des facultés de médecine, ce qui représente un pas significatif vers une meilleure formation des professionnel·les de santé mais encore largement insuffisant. En 2022 la start-up française Ziwig a annoncé la création d’un test salivaire Endoziwig pour diagnostiquer la maladie après des années de recherche. Ce test utilise l’analyse de l’ARN contenu dans la salive pour détecter la présence d’endométriose avec précision de plus de 95% et ce de manière non invasive et rapide. Ce test pourrait améliorer la prise en charge de la maladie en réduisant considérablement le délai d’errance médicale, permettant ainsi un traitement plus précoce et adapté pour les jeunes personnes notamment. Pour en savoir plus sur ce test et son déploiement, veuillez consulter la page dédiée.
Aujourd’hui, la recherche continue pour améliorer le dépistage et les traitements de cette maladie complexe et invalidante, reflétant une histoire marquée par des progrès, des reculs, et une longue lutte pour la reconnaissance médicale et sociale.
Les théories sur l’origine de la maladie
L’endométriose est une maladie complexe dont les origines exactes restent incertaines. Plusieurs théories ont été proposées, mais aucune n’a été définitivement approuvée. Elles ont été dominé principalement dominées par les deux premières hypothèses : la théorie des menstruations rétrogrades et la théorie de la métaplasie. Mais aujourd’hui de nombreuses autres théories plus récentes ont vu le jour, qui tentent d’expliquer l’origine de l’endométriose ou bien son développement. Il est de plus en plus envisagé que plusieurs mécanismes issus de plusieurs théories sont à l’œuvre et peuvent même se compléter. Ainsi chacune de ces théories apporte une perspective différente sur la pathogénèse de la maladie, reflétant la complexité et la diversité des manifestations de l’endométriose.
Références
- Bourdel N, Chauvet P, Billone V, Douridas G, Fauconnier A, Gerbaud L, et al. Systematic review of quality of life measures in patients with endometriosis. PLoS ONE [Internet]. 10 janv 2019 ; 14(1) : e0208464. Disponible sur ce lien. ↩︎
- Kvaskoff M, Mu F, Terry KLet al. Endometriosis: a high-risk population for major chronic diseases? Hum Reprod Update 2015 ; 21 : 500–516. Disponible sur ce lien. ↩︎
- Endométriose · Inserm, La science pour la santé [Internet]. 2024. Disponible sur ce lien. ↩︎
- Godin SK, Wagner J, Huang P, Bree D. The role of peripheral nerve signaling in endometriosis. FASEB BioAdvances [Internet]. 2 août 2021 ; 3(10) : 802‑13. Disponible sur ce lien. ↩︎
- Strehl JD, Hackl J, Wachter DL, Klingsiek P, Burghaus S, Renner SP, Fasching PA, Hartmann A, Beckmann MW. Correlation of histological and macroscopic findings in peritoneal endometriosis. Int J Clin Exp Pathol. 2013 Dec 15;7(1):152-62. Disponible sur ce lien. ↩︎
- Chantalat E, Valera MC, Vaysse C, Noirrit E, Rusidze M, Weyl A, et al. Estrogen Receptors and Endometriosis. International Journal Of Molecular Sciences [Internet]. 17 avr 2020 ; 21(8) : 2815. Disponible sur ce lien. ↩︎
- Vetvicka V, Laganà AS, Salmeri FM, Triolo O, Palmara VI, Vitale SG, et al. Regulation of apoptotic pathways during endometriosis : from the molecular basis to the future perspectives. Archives Of Gynecology And Obstetrics [Internet]. 15 sept 2016 ; 294(5) : 897‑904. Disponible sur ce lien. ↩︎
- Ahn SH, Khalaj K, Young SL, Lessey BA, Koti M, Tayade C. Immune-inflammation gene signatures in endometriosis patients. Fertility And Sterility [Internet]. 28 juill 2016 ; 106(6) : 1420-1431.e7. Disponible sur ce lien. ↩︎
- Pavone ME, Bulun SE. Aromatase inhibitors for the treatment of endometriosis. Fertility And Sterility [Internet]. 19 sept 2012 ; 98(6) : 1370‑9. Disponible sur ce lien. ↩︎
- Zhang P, Wang G. Progesterone Resistance in Endometriosis : Current Evidence and Putative Mechanisms. International Journal Of Molecular Sciences [Internet]. 10 avr 2023 ; 24(8) : 6992. Disponible sur ce lien. ↩︎
- Patel BG, Rudnicki M, Yu J, Shu Y, Taylor RN. Progesterone resistance in endometriosis : origins, consequences and interventions. Acta Obstetricia et Gynecologica Scandinavica [Internet]. 28 mai 2017 ; 96(6) : 623‑32. Disponible sur ce lien. ↩︎
- Ramírez-Pavez TN, Martínez-Esparza M, Ruiz-Alcaraz AJ, Marín-Sánchez P, Machado-Linde F, García-Peñarrubia P. The Role of Peritoneal Macrophages in Endometriosis. International Journal Of Molecular Sciences [Internet]. 6 oct 2021 ; 22(19) : 10792. Disponible sur ce lien. ↩︎
- Da Gama Coelho Riccio L, Santulli P, Marcellin L, Abrão MS, Batteux F, Chapron C. Immunology of endometriosis. Best Practice & Research Clinical Obstetrics & Gynaecology [Internet]. 8 févr 2018 ; 50 : 39‑49. Disponible sur ce lien. ↩︎
- Celik O, Hascalik S, Elter K, Tagluk ME, Gurates B, Aydin NE. Combating endometriosis by blocking proteasome and nuclear factor- B pathways. Human Reproduction [Internet]. 29 juill 2008 ; 23(11) : 2458‑65. Disponible sur ce lien. ↩︎
- McLaren J. Vascular endothelial growth factor and endometriotic angiogenesis. Human Reproduction Update [Internet]. 1 janv 2000 ; 6(1) : 45‑55. Disponible sur ce lien. ↩︎
- Becker CM, D’Amato RJ. Angiogenesis and antiangiogenic therapy in endometriosis. Microvascular Research [Internet]. 1 sept 2007 ; 74(2‑3) : 121‑30. Disponible sur ce lien. ↩︎
- Xu, H., Zhang, T., Man, G.C.W. et al. Vascular endothelial growth factor C is increased in endometrium and promotes endothelial functions, vascular permeability and angiogenesis and growth of endometriosis. Angiogenesis 16, 541–551 (2013). Disponible sur ce lien. ↩︎
- Vissers G, Giacomozzi M, Verdurmen W, Peek R, Nap A. The role of fibrosis in endometriosis : a systematic review. Human Reproduction Update [Internet]. 8 juill 2024 ; 30(6) : 706‑50. Disponible sur ce lien. ↩︎
- Yang HL, Zhou WJ, Chang KK, Mei J, Huang LQ, Wang MY, et al. The crosstalk between endometrial stromal cells and macrophages impairs cytotoxicity of NK cells in endometriosis by secreting IL-10 and TGF-β. Reproduction [Internet]. 3 oct 2017 ; 154(6) : 815‑25. Disponible sur ce lien. ↩︎
- Chung MS, Han SJ. Endometriosis-Associated Angiogenesis and Anti-angiogenic Therapy for Endometriosis. Frontiers In Global Women S Health [Internet]. 5 avr 2022 ; 3. Disponible sur ce lien. ↩︎
- Velebil P, Wingo PH, Xia R. Rate of hospitalisation for gynecologic disorders among reproductive-age women in the United States. Obstet Gynecol 1995;86:764. [5] Gao X, Outley J. Economic burden of endometriosis. Fertil Steril 2006;86:1561—71. Disponible sur ce lien ↩︎
- Advances in Endometriosis Research. In: World Congress on Endometriosis, WCE; 2014 mars 30-avril 2; São Paulo, Brésil. ↩︎
- Définition – endometriose.fr [Internet]. Disponible sur ce lien. ↩︎
- Horne AW, Missmer SA. Pathophysiology, diagnosis, and management of endometriosis. BMJ [Internet]. 14 nov 2022 ; e070750. Disponible sur ce lien. ↩︎
- Endométriose : définition et facteurs favorisants [Internet]. ameli.fr | Assuré. Disponible sur ce lien. ↩︎
- Nnoaham KE, Hummelshoj L, Webster P, D’Hooghe T, De Cicco Nardone F, De Cicco Nardone C, et al. Impact of endometriosis on quality of life and work productivity : a multicenter study across ten countries. Fertility And Sterility [Internet]. 1 août 2011 ; 96(2) : 366-373.e8. Disponible sur ce lien. ↩︎
- Simoens S, Dunselman G, Dirksen C, Hummelshoj L, Bokor A, Brandes I, et al. The burden of endometriosis : costs and quality of life of women with endometriosis and treated in referral centres. Human Reproduction [Internet]. 14 mars 2012 ; 27(5) : 1292‑9. Disponible sur ce lien. ↩︎
- Rosenbaum J, Bourdel N, Khochbin S, Kvaskoff M, Matsuzaki S, Mechta-Grigoriou F, et al. Des pistes de réflexion pour la recherche sur l’endométriose en France. Médecine/Sciences [Internet]. 1 mars 2022 ; 38(3) : 274‑9. Disponible sur ce lien. ↩︎
- Hudelist G, Fritzer N, Thomas A, Niehues C, Oppelt P, Haas D, et al. Diagnostic delay for endometriosis in Austria and Germany : causes and possible consequences. Human Reproduction [Internet]. 17 sept 2012 ; 27(12) : 3412‑6. Disponible sur ce lien. ↩︎
- Kamińska MA, Czach M, Dąbrowska A, Gonciarz MJ, Zaliwska D, Paduszyńska N, Strojny AA, Adamiec DK, Kraszkiewicz A, Do MK. Endometriosis: Classification, Risk factors, Diagnosis and management – Review of Literature. Qual Sport [Internet]. 2024 Sep. 17 [cited 2024 Sep. 24];22:54531Disponible sur ce lien. ↩︎
- Stefansson H, Geirsson RT, Steinthorsdottir V, Jonsson H, Manolescu A, Kong A, et al. Genetic factors contribute to the risk of developing endometriosis. Human Reproduction [Internet]. 1 mars 2002 ; 17(3) : 555‑9. Disponible sur ce lien. ↩︎
- Shafrir AL, Farland LV, Shah DK, Harris HR, Kvaskoff M, Zondervan K, et al. Risk for and consequences of endometriosis : A critical epidemiologic review. Best Practice & Research Clinical Obstetrics & Gynaecology [Internet]. 3 juill 2018 ; 51 : 1‑15. Disponible sur ce lien. ↩︎
- Viganò P, Parazzini F, Somigliana E, Vercellini P. Endometriosis : epidemiology and aetiological factors. Best Practice & Research Clinical Obstetrics & Gynaecology [Internet]. 1 avr 2004 ; 18(2) : 177‑200. Disponible sur ce lien. ↩︎
- Pan G, Zhang P, Li S, Cao L, Yang C. Association of endometriosis with asthma : a study of the NHANES database in 1999–2006. Journal Of Health Population And Nutrition [Internet]. 9 avr 2024 ; 43(1). Disponible sur ce lien. ↩︎
- Treloar SA, O’Connor DT, O’Connor VM, Martin NG. Genetic influences on endometriosis in an Australian twin sample. Fertility And Sterility [Internet]. 1 avr 1999 ; 71(4) : 701‑10. Disponible sur ce lien. ↩︎
- Treloar SA, Wicks J, Nyholt DR, Montgomery GW, Bahlo M, Smith V, et al. Genomewide Linkage Study in 1,176 Affected Sister Pair Families Identifies a Significant Susceptibility Locus for Endometriosis on Chromosome 10q26. The American Journal Of Human Genetics [Internet]. 1 sept 2005 ; 77(3) : 365‑76. Disponible sur ce lien. ↩︎
- Rahmioglu N, Mortlock S, Ghiasi M, Møller PL, Stefansdottir L, Galarneau G, et al. The genetic basis of endometriosis and comorbidity with other pain and inflammatory conditions. Nature Genetics [Internet]. 1 mars 2023 ; 55(3) : 423‑36. Disponible sur ce lien. ↩︎
- Shafrir AL, Farland LV, Shah DK, Harris HR, Kvaskoff M, Zondervan K, et al. Risk for and consequences of endometriosis : A critical epidemiologic review. Best Practice & Research Clinical Obstetrics & Gynaecology [Internet]. 3 juill 2018 ; 51 : 1‑15. Disponible sur ce lien. ↩︎
- Qiu Y, Yuan S, Wang H. Vitamin D status in endometriosis : a systematic review and meta-analysis. Archives Of Gynecology And Obstetrics [Internet]. 19 mai 2020 ; 302(1) : 141‑52. Disponible sur ce lien. ↩︎
- Santanam N, Kavtaradze N, Murphy A, Dominguez C, Parthasarathy S. Antioxidant supplementation reduces endometriosis-related pelvic pain in humans. Translational Research [Internet]. 1 mars 2013 ; 161(3) : 189‑95. Disponible sur ce lien. ↩︎
- Collinet P, Fritel X, Revel-Delhom C, Ballester M, Bolze PA, Borghese B, et al. Management of endometriosis. Journal Of Gynecology Obstetrics And Human Reproduction [Internet]. 18 juin 2018 ; 47(7) : 265‑74. Disponible sur ce lien. ↩︎
- Olšarová K, Mishra GD. Early life factors for endometriosis : a systematic review. Human Reproduction Update [Internet]. 6 mars 2020 ; 26(3) : 412‑22. Disponible sur ce lien. ↩︎
- Ottolina J, Schimberni M, Makieva S, Bartiromo L, Fazia T, Bernardinelli L, et al. Early-life factors, in-utero exposures and endometriosis risk : a meta-analysis. Reproductive BioMedicine Online [Internet]. 1 août 2020 ; 41(2) : 279‑89. Disponible sur ce lien. ↩︎
- Harris HR, Wieser F, Vitonis AF, Rich-Edwards J, Boynton-Jarrett R, Bertone-Johnson ER, et al. Early life abuse and risk of endometriosis. Human Reproduction [Internet]. 20 juin 2018 ; 33(9) : 1657‑68. Disponible sur ce lien. ↩︎
- Liebermann C, Schwartz ASK, Charpidou T, Geraedts K, Rauchfuss M, Wölfler M, et al. Maltreatment during childhood : a risk factor for the development of endometriosis ? Human Reproduction [Internet]. 3 mai 2018 ; 33(8) : 1449‑58. Disponible sur ce lien. ↩︎
- Reis FM, Coutinho LM, Vannuccini S, Luisi S, Petraglia F. Is Stress a Cause or a Consequence of Endometriosis ? Reproductive Sciences [Internet]. 1 janv 2020 ; 27(1) : 39‑45. Disponible sur ce lien. ↩︎
- Sirohi D, Ramadhani RA, Knibbs LD. Environmental exposures to endocrine disrupting chemicals (EDCs) and their role in endometriosis : a systematic literature review. Reviews On Environmental Health [Internet]. 9 sept 2020 ; 36(1) : 101‑15. Disponible sur ce lien. ↩︎
- Cano-Sancho G, Ploteau S, Matta K, Adoamnei E, Louis GB, Mendiola J, et al. Human epidemiological evidence about the associations between exposure to organochlorine chemicals and endometriosis : Systematic review and meta-analysis. Environment International [Internet]. 6 déc 2018 ; 123 : 209‑23. Disponible sur ce lien. ↩︎
- Sak J, Nowiński M, Fus-Mazurkiewicz L, Król D, Mazurkiewicz W. Impact of shift work on women’s reproductive function – a review of the literature. Problemy Pielęgniarstwa [Internet]. 1 janv 2024 ; 32(2) : 59‑63. Disponible sur ce lien. ↩︎
- Petit É. Épidémiologie de l’endométriose. Imagerie de la Femme [Internet]. 16 juill 2016 ; 26(3‑4) : 196‑8. Disponible sur ce lien. ↩︎
- Hamouda RK, Arzoun H, Sahib I, Mendez LE, Srinivasan M, Shoukrie SI, et al. The Comorbidity of Endometriosis and Systemic Lupus Erythematosus : A Systematic Review. Cureus [Internet]. 24 juill 2023 ; Disponible sur ce lien. ↩︎
- Brichant G, Moise A, Nisolle M. L’endométriose est-elle une pathologie inflammatoire ? [Internet]. 2022. Disponible sur ce lien. ↩︎
- Zubrzycka A, Zubrzycki M, Perdas E, Zubrzycka M. Genetic, Epigenetic, and Steroidogenic Modulation Mechanisms in Endometriosis. Journal Of Clinical Medicine [Internet]. 2 mai 2020 ; 9(5) : 1309. Disponible sur ce lien. ↩︎
- Baranov VS, Ivaschenko TE, Liehr T, Yarmolinskaya MI. Systems genetics view of endometriosis : a common complex disorder. European Journal Of Obstetrics & Gynecology And Reproductive Biology [Internet]. 1 févr 2015 ; 185 : 59‑65. Disponible sur ce lien. ↩︎
- Revue Médicale de Liège – Le rôle de la génétique et de l’environnement dans le développement de l’endométriose [Internet]. Disponible sur ce lien. ↩︎
- Khan KN, Kitajima M, Hiraki K, Yamaguchi N, Katamine S, Matsuyama T, et al. Escherichia coli contamination of menstrual blood and effect of bacterial endotoxin on endometriosis. Fertility And Sterility [Internet]. 8 juin 2010 ; 94(7) : 2860-2863.e3. Disponible sur ce lien. ↩︎
- Muraoka A, Suzuki M, Hamaguchi T, Watanabe S, Iijima K, Murofushi Y, et al. Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts. Science Translational Medicine [Internet]. 14 juin 2023 ; 15(700). Disponible sur ce lien. ↩︎
- Caffier C. L’endométriose associée à des anomalies de microbiote : une revue de la littérature [Internet]. 2023. Disponible sur ce lien. ↩︎
- Velemir L, Krief M, Matsuzaki S, Rabischong B, Jardon K, Botchorishvili R, et al. Physiopathologie de l’endométriose. EMC – Gynécologie [Internet]. 1 janv 2008 ; 3(3) : 1‑16. Disponible sur ce lien. ↩︎
Sources bibliographiques
Qu’est ce que l’Endométriose ? [Internet]. Association EndoFrance. 2024. Disponible sur ce lien.
Histoire de l’endométriose [Internet]. Association Endomind. Disponible sur :Disponible sur ce lien.
Galès MR. Endométriose – Ce que les autres pays ont à nous apprendre. 1re éd. Josette Lyon ; 2020.
Lhuillery D, Petit E, Sauvanet E. Tout sur l’endometriose : Soulager la douleur, soigner la maladie. 2e éd. Odile Jacob ; 2017.
Contribuez à l’Endo’cyclopédie
Votre soutien à ce projet est essentiel pour maintenir le site gratuit et accessible à tou·tes.
Consultez la rubrique dédiée pour découvrir pourquoi chaque don compte !
Vous pouvez contribuer en me partageant une ressource qui ne figure pas encore sur le site !